LAS
LEYES PONDERALES.
LEYES
PONDERALES:
También
llamadas leyes de las combinaciones químicas, tratan de las cantidades de las
sustancias que intervienen en las reacciones; en otras palabras; son las que
rigen la proporción en masa y volumen para formar compuestos, para
determinarlos se utilizan cálculos estequiometricos.
y
son:
LEYES
PONDERALES DE LA QUÍMICA
1ª.-
LEY DE LA CONSERVACIÓN DE LA MASA (Lavoisier, 1787)
La
suma de las masas de los productos reaccionantes es igual a la suma de las
masas de los productos de la reacción.
 |
| https://www.google.com.mx/search?q=1%C2%AA.-+LEY+DE+LA+CONSERVACI%C3%93N+DE+LA+MASA+(Lavoisier,+1787)&biw=1366&bih=662&source=lnms&tbm=isch&sa=X&ved=0ahUKEwi kj5yKkOjPAhVnhlQKHeHwCf4Q_AU IBigB#imgrc=qQmGl2cyKJxhMM%3A |
2ª.-
LEY DE LAS PROPORCIONES DEFINIDAS o CONSTANTES (Proust, 1799)
Cuando
dos o más elementos (o sustancias), se unen para formar una sustancia
determinada, lo hacen siempre en proporciones fijas y determinadas.
| https://www.google.com.mx/search?q=1%C2%AA.-+LEY+DE+LA+CONSERVACI%C3%93N+DE+LA+MASA+(Lavoisier,+1787)&biw=1366&bih=662&source=lnms&tbm=isch&sa=X&ved=0a hUKEwikj5yKkOjPAhVnhlQKH eHwCf4Q_AUIBigB#tbm=isch&q=2%C2%AA.-+LEY+DE+LAS+PROPORCIONES+DEFINIDAS+o+CONSTANTES+(Proust%2C+1799)&imgrc=6e6cJGizwUbdPM%3A |
3ª.-
LEY DE LAS PROPORCIONES RECÍPROCAS o DE LOS PESOS DE COMBINACIÓN (Richter,
1792).
Las
masas de elementos diferentes, que se combinan con una misma masa de otro
elemento, son las mismas son las mismas con las que se combinarían entre sí, si
la reacción es posible, o son sus múltiplos o sus submúltiplos.
 |
| https://www.google.com.mx/search?q=1%C2%AA.-+LEY+DE+LA+CONSERVACI%C3%93N+DE+LA+MASA+(Lavoisier,+1787)&biw=1366&bih=662&source=lnms&tbm=isch&sa=X&ved=0ahUKEwikj 5yKkOjPAhVnhlQKHeHwCf4Q_AUIBigB#tbm=isch&q=LEY+D E+LAS+PROPORCIONES+REC%C3%8DPROCAS+o+DE+LOS+PESOS+DE+COMBINACI%C3%93N+(Richter%2C+1792).&imgrc=swTE5kPWUaxkmM%3A |
4ª.-
LEY DE LAS PROPORCIONES MÚLTIPLES (Dalton, 1803).
Las
cantidades de un mismo elemento que se combinan con una cantidad fija de otro,
para formar varios compuestos, están en la relación de los números enteros y
sencillos.
| https://www.google.com.mx/search?q=1%C2%AA.-+LEY+DE+LA+CONSERVACI%C 3%93N+DE+LA+MASA+(Lavoisier,+1787)&biw=1366&bih=662&source=lnms&tbm=isch&s a=X&ved=0ahUKEwikj5yKkOjPAhVnhlQKHeHwCf4Q_AUIBigB#tbm=isch&q=4%C2%AA.-+LEY+DE+LAS+PROPORCIONES+M%C3%9ALTIPLES+(Dalton%2C+1803).&imgrc=ppxM_5VCNONKwM%3A |
5ª.-
LEY DE LOS VOLÚMENES DE COMBINACIÓN (Gay-Lussac, 1808).
Los
volúmenes, medidos en las mismas condiciones de presión y temperatura, de las
sustancias gaseosas que intervienen en una reacción química, están en una
relación de números enteros y sencillos.
 |
| https://www.google.com.mx/search?q=1%C2%AA.-+LEY+DE+LA+CONSERVACI%C3%93N+DE+LA+MASA+(Lavoisier,+1787)&biw=1366&bih=662&source=lnms&tbm=isch&sa=X&ved=0ahUKEwikj5yKkOjPAhVnhlQKHeHw Cf4Q_AUIBigB#tbm=isch&q=5%C2%AA.-+LEY+DE+LOS+VOL%C3%9AMENES+DE+COMBINACI%C3%93N+(Gay-Lussac%2C+1808).&imgrc=ajGCbstIuO6a-M%3A |
6ª.-
LEY DE AVOGADRO (1811).
.jpg/300px-Sintesis_NH3(3).jpg) A
igualdad de presión y temperatura, volúmenes iguales de sustancias gaseosas con
tiene el mismo número de moléculas.
A
igualdad de presión y temperatura, volúmenes iguales de sustancias gaseosas con
tiene el mismo número de moléculas.
https://www.google.com.mx/search?q=1%C2%AA.-+LEY+DE+LA+CONSERVACI%C3%93N+DE+LA+MASA+(Lavoisier,+1787)&biw=1366&bih=662&source=lnms&tbm=isch&sa=X&ved=0ahUKEwikj5yKkOjPAhVnhlQKHeHwCf4Q_AUIBigB#tbm=isch&q=.-+LEY+DE+AVOGADRO+(1811).&imgrc=kjuN_aiELs2YjM%3A
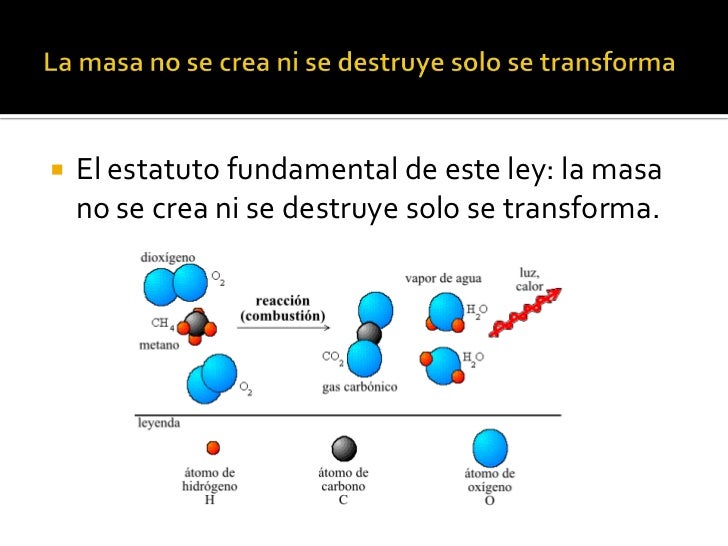
Ley de Lavoisier o ley de la
conservación de la masa
“La masa no se crea ni se destruye, sólo se transforma”. En una
reacción química la suma de la masa de los reactivos es igual a la suma de la
masa de los productos.
Lavoisier demostró que al efectuarse una
reacción química la masa no se crea ni se destruye, sólo se transforma, es
decir, las sustancias reaccionantes al interactuar entre sí forman nuevos
productos con propiedades físicas y químicas diferentes a las de los reactivos,
esto debido a que los átomos de las sustancias se ordenan de forma distinta.
Ejemplo 1:
Demuestre que la siguiente ecuación quimica cumple con la ley de conservacion de la masa, si las masas molares son:
mr KCL=74.5g
Mr AgNO3= 169g
Mr KNO3=101g
Mr AgCl= 142.5g
agNO3+KCL ---- KNO3+AgCl
16g + 74.5g---- 101g+142.5g
243.5g ----- 243,5g
Ejemplo2:
la masa atomica de hg0 es:
hg=2000,59g
0=ig
Verifique si la ecuacion cumple con la Ley de la conservación de la materia
(hay que balancealar)
2hgO ------ 2 hg + 02
2(200,59+16g) -------2 (200,59)+(16g+2)
2(216,59g) ------ 2 (200,59)+(32g)
433,18g ----- 401,18+32g
433,18g ----- 433,18g
Demuestre que la siguiente ecuación quimica cumple con la ley de conservacion de la masa, si las masas molares son:
mr KCL=74.5g
Mr AgNO3= 169g
Mr KNO3=101g
Mr AgCl= 142.5g
agNO3+KCL ---- KNO3+AgCl
16g + 74.5g---- 101g+142.5g
243.5g ----- 243,5g
Ejemplo2:
la masa atomica de hg0 es:
hg=2000,59g
0=ig
Verifique si la ecuacion cumple con la Ley de la conservación de la materia
(hay que balancealar)
2hgO ------ 2 hg + 02
2(200,59+16g) -------2 (200,59)+(16g+2)
2(216,59g) ------ 2 (200,59)+(32g)
433,18g ----- 401,18+32g
433,18g ----- 433,18g
Definición de la Ley de Proust
La ley de Proust puede ser enunciada de
la siguiente manera:
Cuando dos sustancias se combinan para
forman un compuesto, ellas deben guardar entre si, las proporciones ciertas y
definidas.
Explicación de la Ley
Como ejemplo, para obtener sulfato de hierro, debemos combinar el hierro
y el azufre en la siguiente proporción: 7 partes de hierro, por 4 partes de
azufre. Así obtenemos 11 partes de sulfato de hierro
De acuerdo con la ley tenemos:
7g de hierro + 4g de azufre = 11g de sulfato de hierro
Combinando 9gr. de hierro con 4 gr. de azufre, aún así conseguimos 11
gr. de sulfato de hierro, pero sobran 2 gr. de hierro.
De la misma forma, al combinar 7 gr. de hierro con 5 gr. de azufre,
vamos a obtener también 11 gr. de sulfato de hierro, pero ahora nos sobrará 1
gr- de azufre.
Observa que, en esta combinación, la cantidad de hierro y azufre puede
ser diferente de 7 gr. y 4 gr., respectivamente, pero ambas substancias
reaccionan siempre en la relación de 7 a 4.
cielo aguilar
Bibliografía
2, p. d. (sf). portafolio de quimica 2. Recuperado
el 30 de 9 de 16, de
https://sites.google.com/a/lazarocardenas.edu.mx/angelzamoradaliagpe-quimica2/1-bloque-i-aplicas-la-nocion-de-mol-en-la-cuantificacion-en-procesos-quimicos-en-tu-entorno/1-2-las-leyes-ponderales
brainly. (29 de 10 de
12). brainly. Recuperado el 10 de 10 de 16, de
http://brainly.lat/tarea/89260
González, A. J. (sf). apoyo
educativo sep. Recuperado el 1 de 10 de 16, de
http://www.aev.cgfie.ipn.mx/Materia_quimica/publicacion/temas/tema1/subtema4/subtema4.html
monica. (13). guia
quimica. Recuperado el 10 de 10 de 16, de Ley de las proporciones
definidas, o Ley de Proust. | La Guía de Química
http://quimica.laguia2000.com/general/ley-de-las-proporciones-definidas-o-ley-de-proust#ixzz4Na1cUUoA
No hay comentarios:
Publicar un comentario