CONCEPTO
DE ENLACE QUIMICO O UNION QUIMICA
POR:YESICA VILLAGOMEZ VEGA
Un enlace químico corresponde a la fuerza que
une o enlaza a dos átomos, sean estos iguales o distintos. Los enlaces se
pueden clasificar en tres grupos principales: enlaces iónicos, enlaces
covalentes y enlaces dativos. Los enlaces se producen como resultado de los
movimientos de los electrones de los átomos, sin importar el tipo de enlace que
se forme. Pero no cualquier electrón, puede formar un enlace, sino solamente
los electrones del último nivel energético (más externo). A estos se les llama
electrones de valencia.
|
Enlaces
|
Descripción
|
||||
|
Enlace Ionico
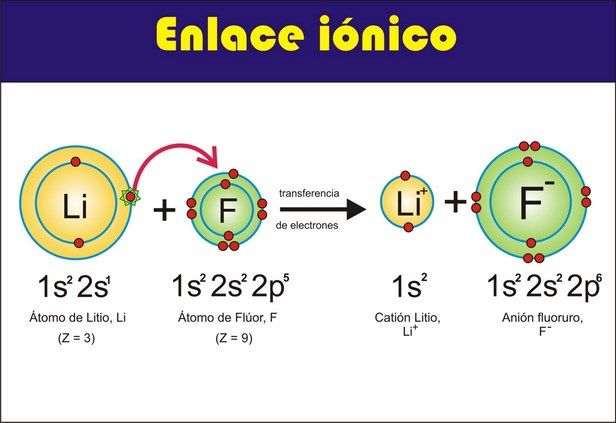 |
Un enlace iónico se puede
definir como la fuerza que une a dos átomos a través de una cesión
electrónica. Una cesión electrónica se da cuando un elemento electropositivo
se une con un elemento electronegativo. Mientras mayor sea la diferencia de
electronegatividad entre los elementos, más fuerte será el enlace iónico. Se
empieza a considerar que dos átomos están unidos a través de un enlace iónico
cuando su diferencia de electronegatividad es superior a 1.7. Un ejemplo de
un compuesto unido a través de enlace iónico se muestra en la Imagen 27,
mientras que en la Imagen 28 se ve algunas maneras de escribir compuestos
unidos mediante este tipo de enlace.
|
||||
|
Enlace Covalente
-No Polar
|
El enlace covalente es la fuerza que une dos átomos
mediante la compartición de un electrón por átomo. Dentro de este tipo de
enlace podemos encontrar dos tipos: el enlace covalente polar y
el enlace covalente apolar. El primer sub-tipo corresponde a todos
aquellos compuestos en donde la diferencia de electronegatividad de los
átomos que lo componen va desde 0 hasta 1.7 (sin considerar el 0).
Los compuestos que son polares se caracterizan por ser asimétricos, tener un
momento dipolar (el momento dipolar es un factor que indica hacia donde se concentra
la mayor densidad electrónica) distinto a 0, son solubles en agua y otros
solventes polares, entre otras características.
|
||||
|
Enlace covalente Coordinado o
Dativo
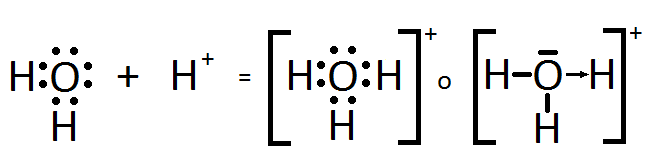 |
Este tipo de enlace se
caracteriza porque el par electrónico del enlace es entregado por un sólo
átomo, el cual debe poseer a lo menos un par de electrones libres sin enlazar
(Como el Oxígeno, Nitrógeno o Cloro, por ejemplo). Otra característica
importante es que el átomo que acepta el par electrónico debe estar carente
de electrones (como el ión hidrógeno [más conocido como protón], el Aluminio,
entre otros). Este tipo de enlace es muy importante para el capítulo de
ácidos-bases (que se verá a continuación) debido a que una teoría ácido-base
indica que un ácido es aquella sustancia química que es capaz de aceptar un
par electrónico y una base una sustancia capaz de compartirlos. También los
enlaces dativos sirven para poder comprender de mejor manera la disolución de
sustancias (tema que se verá más adelante).
|
||||
|
Enlace Metalico
 |
Es el tipo de enlace que se
produce cuando se combinan entre sí los elementos metálicos; es decir,
elementos de electronegatividades bajas y que se diferencien poco.
Los metales forman unas redes
metálicas compactas; es decir, con elevado índice de coordinación, por lo que
suelen tener altas densidades. Las redes suelen ser hexagonales y cúbicas.
|

No hay comentarios:
Publicar un comentario