Las propiedades periódicas de los elementos químicos, son características propias de dichos elementos que varían de acuerdo a su posición en la tabla periódica, ósea dependiendo de su número atómico.
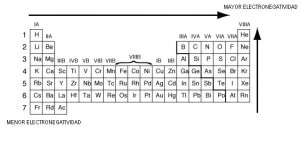
Las propiedades periódicas son: electronegatividad, electropositividad, radio atómico, afinidad electrónica, potencial de ionización, la densidad atómica, el volumen atómico, temperatura de fusión y temperatura de ebullición.
Aunque las cuatro ultimas propiedades mencionadas muchas veces son consideradas aperiódicas
Las propiedades mayormente estudiadas son.
Electronegatividad
La es la tendencia que un átomo tiene para atraer hacia el los electrones cuando forma un enlace químico.
La electronegatividad tiene la particularidad de no poder ser dimensionada directamente por lo que necesita de otro tipo de cálculos basados en otras propiedades atómicas o moleculares para ser determinada.
Radio atómico: Básicamente es la distancia que hay entre el centro del núcleo hasta el electrón más externo. Si nos ubicamos dentro de un mismo grupo (vertical), como por ejemplo el grupo I (Alcalinos), le radio atómico será mayor obviamente para el Francio que se encuentra en el nivel o período 7 que el Litio que está en el 2. Al estar en el nivel 7 se encontrara a mayor distancia del núcleo por eso tendrá mayor radio atómico que el Litio. Ahora si estudiamos esta propiedad a nivel horizontal es algo más complicado de entender. Si estamos en un mismo nivel veremos que el número atómico crece hacia la derecha. Esto significa que un elemento ubicado más a la derecha tendrá mayor cantidad de electrones que su vecino de la izquierda. Al tener más electrones tendrá más protones (cargas positivas). Por lo tanto habrá más fuerza de atracción de los electrones hacia el núcleo y esto provocara una reducción aunque sea pequeña del radio atómico ya que la nube electrónica se acercara más al núcleo. En conclusión, los elementos ubicados más a la derecha dentro de un cierto nivel, tendrán menor radio atómico que los ubicados a la izquierda. Por eso, el radio atómico disminuye hacia la derecha.
Potencial de ionización: Es la energía que hay que entregar para arrancarle el electrón más externo a un átomo en su estado neutro y gaseoso. Cuando se trata del electrón más externo hablamos de la primera energía o potencial de ionización y si se trata por ejemplo del segundo será la segunda energía o potencial de ionización. Generalmente las bibliografías hablan más de la primera energía. Con respecto a un grupo esta energía aumenta de abajo hacia arriba. Se entiende porque si volvemos al ejemplo del grupo I será más complicado extraerle el electrón más externo al Litio o al Sodio que al Francio que está muy lejos del núcleo (nivel 7). Al estar tan lejos del núcleo hay muy poca atracción y por lo tanto es más fácil sacarle su electrón. Si ahora planteamos la misma situación a nivel de un periodo, o sea, horizontalmente, ocurre algo similar comparado con el radio atómico. Aumenta hacia la derecha porque hay mayor densidad electrónica en los elementos ubicados más a la derecha por tener mayor número atómico. Al estar con más electrones, habrán más protones y mayor atracción. Por este motivo se necesitara más energía o potencial para arrancarle algún electrón.
Las flechas apuntan hacia el aumento de la propiedad mencionada. En los casos de iones también varían con respecto a sus átomos predecesores. Por ejemplo, el cloro al ganar un electrón queda negativo y su radio por consecuencia crecerá. Al contrario pasara con el sodio que al perder el electrón más externo se convertirá en un ion positivo con un radio obviamente menor al átomo de sodio neutro.
Lee todo en: Propiedades Periódicas de los elementos | La Guía de Química http://quimica.laguia2000.com/conceptos-basicos/propiedades-periodicas-de-los-elementos#ixzz45lGuXWbR
http://www.quimicayalgomas.com/quimica-general/propiedades-periodicas-de-los-elementos/
echo por maría zamora

No hay comentarios:
Publicar un comentario