 |
http://marcepallaso.wikispaces.com/file/view/320px-Nucleo_generico.jpg/313533778/320px-Nucleo_generico.jpgMASA ATÓMICA Y NUMERO ATÓMICO |
Los átomos están formados por un núcleo (formado por protones y neutrones), de tamaño reducido y cargado positivamente, rodeado por una nube de electrones, que se encuentran en la corteza.
El número de protones que existen en el núcleo, es igual al número de electrones que lo rodean. Este número es un entero, que se denomina número atómico y se designa por la letra, "Z".
La suma del número de protones y neutrones en el núcleo se denomina número másico del átomo y se designa por la letra, "A".

El número de neutrones de un elemento químico se puede calcular como A-Z, es decir, como la diferencia entre el número másico y el número atómico. No todos los átomos de un elemento dado tienen la misma masa. La mayoría de los elementos tiene dos ó más isótopos, átomos que tienen el mismo número atómico, pero diferente número másico. Por lo tanto la diferencia entre dos isótopos de un elemento es el número de neutrones en el núcleo. En un elemento natural, la abundancia relativa de sus isótopos en la naturaleza recibe el nombre de abundancia isotópica natural. La denominada masa atómica de un elemento es una media de las masas de sus isotópos naturales ponderada de acuerdo a su abundancia relativa.
 |
A = masa atómica del elemento natural
Ai = masa atómica de cada isótopo
xi = porcentaje de cada isótopo en la mezcla
|
La nube de carga electrónica constituye casi todo el volumen del átomo, pero, sólo representa una pequeña parte de su masa. Los electrones, particularmente la masa externa determinan la mayoría de las propiedades mecánicas, eléctricas, químicas, etc., de los átomos, y así, un conocimiento básico de estructura atómica es importante en el estudio básico de los materiales de ingeniería.
Veamos una serie de ejemplos
El carbono tiene dos isótopos: uno con A=12, con 6 neutrones y otro con número másico 13 (7 neutrones), que se representan como:


El carbono con número másico 12 es el más común (~99% de todo el carbono). Al otro isótopo se le denomina carbono-13
EL NÚMERO ATÓMICO Y EL NÚMERO MÁSICO
| ||
La identidad de un átomo y sus propiedades vienen dadas por el número de partículas que contiene. Lo que distingue a unos elementos químicos de otros es el número de protones que tienen sus átomos en el núcleo. Este número se llama Número atómico y se representa con la letra Z. Se coloca como subíndice a la izquierda del símbolo del elemento correspondiente. Por ejemplo, todos los átomos del elemento Hidrógeno tienen 1 protón y su Z = 1, los de helio tienen 2 protones y Z =2, los de litio, 3 protones y Z = 3,…
Si el átomo es neutro, el número de electrones coincide con el de protones y nos lo da Z.
|
El Número másico nos indica el número total de partículas que hay en el núcleo, es decir, la suma de protones y neutrones. Se representa con la letra A y se sitúa como superíndice a la izquierda del símbolo del elemento. Representa la masa del átomo medida en uma, ya que la de los electrones es tan pequeña que puede despreciarse.
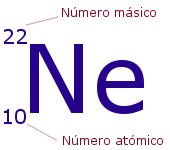
En el ejemplo, tendríamos un átomo del elemento neón, con 10 protones en su núcleo y 10 electrones en su corteza (es neutro). Tendría también: 22-10 = 12 neutrones.
| |
fuente:
http://www.eis.uva.es/~qgintro/atom/tutorial-05.html
http://newton.cnice.mec.es/materiales_didacticos/el_atomo/zya.htm?4
elaborado por yesica vega
elaborado por yesica vega
No hay comentarios:
Publicar un comentario