FUERZAS INTERMOLECULARES
POR:YESICA VILLAGOMEZ VEGA
Las fuerzas
intermoleculares se definen como el conjunto de fuerzas atractivas y repulsivas
que se producen entre las moléculas como consecuencia de la presencia o
ausencia de electrones.
Cuando dos o más átomos
se unen mediante un enlace químico forman una molécula, los electrones que
conforman la nueva molécula recorren y se concentran en la zona del átomo con
mayor electronegatividad, definimos la electronegatividad como la propiedad que
tienen los átomos en atraer electrones. La concentración de electrones en una
zona específica de la molécula crea una carga negativa, mientras que la
ausencia de los electrones crea una carga positiva.

·
Fuerzas Van
Der Walls
El término "fuerzas
de van der Waals" engloba colectivamente a las fuerzas de atracción entre
las moléculas. Son fuerzas de atracción débiles que se establecen entre
moléculas eléctricamente neutras (tanto polares como no polares), pero son muy
numerosas y desempeñan un papel fundamental en multitud de procesos biológicos.
Las fuerzas de van der
Waals incluyen:
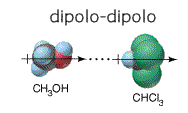
-Fuerzas dipolo-dipolo
Una molécula es un dipolo cuando existe una distribución asimétrica de
los electrones debido a que la molécula está formada por átomos de distinta
electronegatividad. Como consecuencia de ello, los electrones se encuentran
preferentemente en las proximidades del átomo más electronegativo. Se crean así
dos regiones (o polos) en la molécula, una con carga parcial negativa y otra
con carga parcial positiva (Figura inferior izquierda).
Cuando dos moléculas polares (dipolos) se aproximan, se produce una
atracción entre el polo positivo de una de ellas y el negativo de la otra. Esta
fuerza de atracción entre dos dipolos es tanto más intensa cuanto mayor es la
polarización de dichas moléculas polares o, dicho de otra forma, cuanto mayor
sea la diferencia de electronegatividad entre los átomos enlazados (Figura
inferior derecha).
Los enlaces serán tanto más polares cuanto mayor sea la diferencia de
electronegatividad entre los átomos enlazados (ver tabla inferior).
- Dipolo-dipolo Inducido
Tienen lugar entre una molécula polar y una molécula apolar. En este
caso, la carga de una molécula polar provoca una distorsión en la nube
electrónica de la molécula apolar y la convierte, de modo transitorio, en un
dipolo. En este momento se establece una fuerza de atracción entre las
moléculas.
Gracias a esta interacción, gases apolares como el O2, el N2 o el CO2 se
pueden disolver en agua.
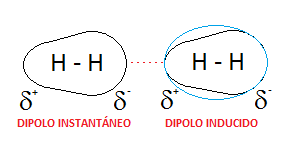
-Fuerza de dispersion de London
fuerzas de tipo intermolecular. Dichas fuerzas tienen lugar entre
moléculas de tipo no polar, donde pueden encontrarse dipolos.
Cuando se representan los orbitales de átomos y moléculas, la
distribución de los electrones, es decir, la densidad electrónica, es el valor
promediado en el tiempo. Lo que da origen a la atracción entre moléculas
vecinas son las oscilaciones respecto a dicho valor promediado en el tiempo.
Los átomos de los gases nobles nos proporcionan el ejemplo más sencillo. En
promedio, la densidad electrónica debería ser esféricamente simétrica alrededor
del núcleo atómico. Sin embargo, la gran parte del tiempo, los electrones
tienen una distribución asimétrica; en consecuencia de esto, una parte del
átomo tiene una densidad electrónica mayor y en otra la densidad electrónica es
menor.

Puente de hidrogeno
constituyen un caso especial de
interacción dipolo-dipolo (Figura de la derecha). Se producen cuando un átomo
de hidrógeno está unido covalentemente a un elemento que sea:
muy electronegativo y con dobletes electrónicos sin compartir
de muy pequeño tamaño y capaz, por tanto, de aproximarse al núcleo del
hidrógeno
Estas condiciones se cumplen en el caso de los átomos de F, O y N.
El enlace que forman con el hidrógeno es muy polar y el átomo de
hidrógeno es un centro de cargas positivas que será atraído hacia los pares de
electrones sin compartir de los átomos electronegativos de otras moléculas Se
trata de un enlace débil (entre 2 y 10 Kcal/mol). Sin embargo, como son muy
abundantes, su contribución a la cohesión entre biomoléculas es grande.
La distancia entre los átomos electronegativos unidos mediante un puente
de hidrógeno suele ser de unos 3 Å. El hidrógeno se sitúa a 1Å del átomo al que
está covalentemente unido y a 2 Å del que cede sus e- no apareados

No hay comentarios:
Publicar un comentario