REACCIONES QUIMICAS
TIPOS DE REACCIONES QUIMICAS
Una reacción química consiste en el cambio de una o mas sustancias en otra(s). Los reactantes son las sustancias involucradas al inicio de la reacción y los productos son las sustancias que resultan de la transformación. En una ecuación química que describe una reacción, los reactantes, representados por sus fórmulas o símbolos, se ubican a la izquierda de una flecha; y posterior a la flecha, se escriben los productos, igualmente simbolizados. En una ecuación se puede indicar los estados físicos de las sustancias involucradas de la manera siguiente: (s) para sólido, (l) para líquido, (g) para gaseoso y (ac) para soluciones acuosas. Los catalizadores, temperaturas o condiciones especiales deben especificarse encima de la flecha. (amschool,2012)
Reacción de síntesis. Elementos o compuestos sencillos que se unen para formar un compuesto más complejo.
A + B ➔ AB
Donde A y B representan cualquier sustancia química.
 |
| http://image.slidesharecdn.com/reaccionesquimicas-111006212343-phpapp01/95/quimica-reacciones-quimicas-12-728.jpg?cb=1317936285 |
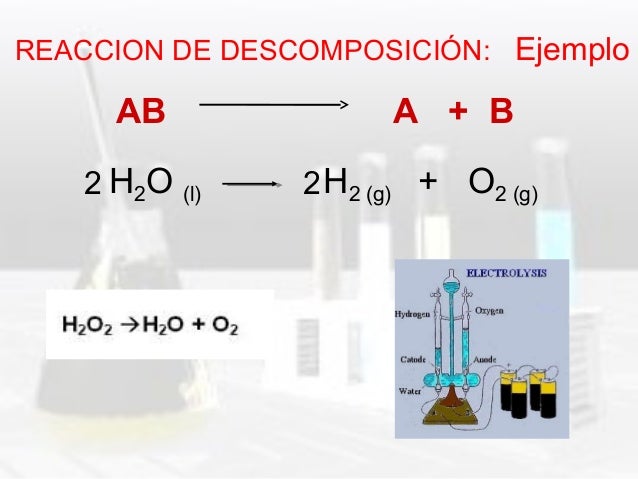
Reacción de descomposición o análisis. Un compuesto se fragmenta en elementos o compuestos más sencillos. En este tipo de reacción un solo reactivo se convierte en dos o más productos.
AB ➔ A + B
 |
| http://image.slidesharecdn.com/reaccionesquimicasi-140502135353-phpapp02/95/reacciones-quimicas-i-9-638.jpg?cb=1399038903 |
Reacción de desplazamiento o simple sustitución. Un elemento reemplaza a otro en un compuesto. Electropositivo reemplaza a electropositivo y electronegativo reemplaza a electronegativo.
A + BC ➔ AC + B
 |
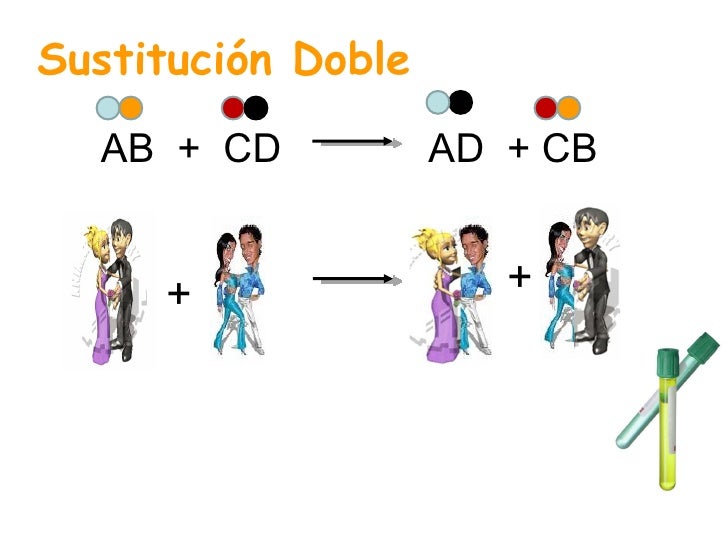
| http://es.slideshare.net/tango67/tipos-de-reacciones-qumicas Reacción de doble desplazamiento o doble sustitución. Los iones en un compuesto cambian lugares con los iones de otro compuesto para formar dos sustancias diferentes. |
AB + CD ➔ AD + BC
 |
(ite,sf)
realizado por maría zamora
Bibliografía
amschool. (2012). amschool. Recuperado el 28 de 8
de 2016, de http://www.amschool.edu.sv/paes/science/reacciones.htm
ite. (s.f.). itec.
Recuperado el 27 de 8 de 2016, de
http://cirocastillo.com/digiteca/reaccionesquimicas1b/tipos_de_reacciones.html
No hay comentarios:
Publicar un comentario