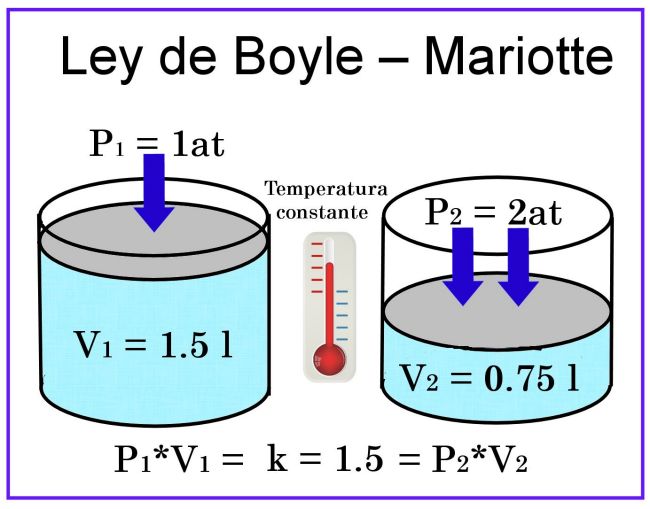
LEY DE BOYLE
Relación entre la presión y el volumen de un gas cuando la temperatura es constante
Fue descubierta por Robert Boyle en 1662. Edme Mariotte también llegó a la misma conclusión que Boyle, pero no publicó sus trabajos hasta 1676. Esta es la razón por la que en muchos libros encontramos esta ley con el nombre de Ley de Boyle y Mariotte.
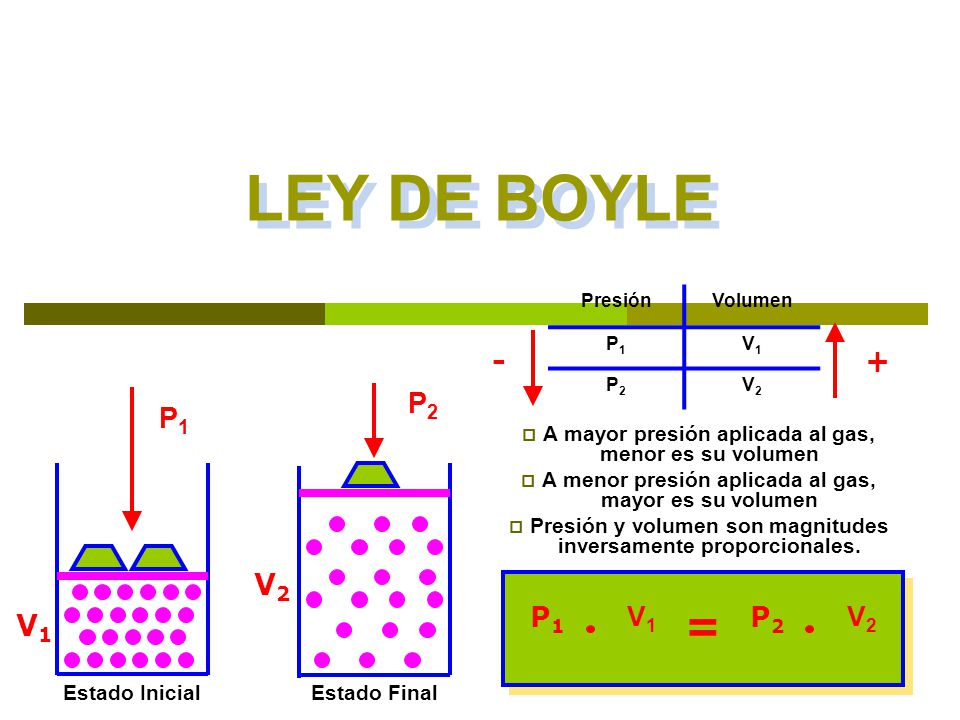
La ley de Boyle establece que la presión de un gas en un recipiente cerrado es inversamente proporcional al volumen del recipiente, cuando la temperatura es constante.
 |
| https://www.google.com.mx/search?q=leyes+de+boyle&biw=1366&bih=662&source=lnms&tbm=isch&sa=X&sqi=2&ved=0ahUKEwiw xu7srIvQAhUni1QKHQyIDWkQ_AUIBigB&dpr=1#imgrc=hDH49Sdv-fyjVM%3A 
Ley de Charles
En 1787, Jack Charles estudió por primera vez la relación entre el volumen y la temperatura de una muestra de gas a presión constante y, observó que cuando se aumentaba la temperatura el volumen del gas también aumentaba y que al enfriar el gas, el volumen disminuía.
¿Por qué ocurre esto?
Cuando aumentamos la temperatura del gas las moléculas se mueven con más rapidez y tardan menos tiempo en alcanzar las paredes del recipiente. Esto quiere decir que el número de choques por unidad de tiempo será mayor. Es decir se producirá un aumento (por un instante) de la presión en el interior del recipiente y aumentará el volumen (el émbolo se desplazará hacia arriba hasta que la presión se iguale con la exterior).
Lo que Charles descubrió es que a presión constante, el cociente entre el volumen y la temperatura de una cantidad fija de gas, es igual a una constante.
(educaplus,12)
Ley de Gay-Lussac
Esta Ley fue enunciada por Joseph Louis Gay-Lussac a principios de 1800. Establece que la presión de un volumen fijo de gas, es directamente proporcional a su temperatura.
¿Por qué ocurre esto?
Al aumentar la temperatura, las moléculas del gas se mueven más rápidamente y por tanto aumenta el número de choques contra las paredes, es decir aumenta la presión ya que el recipiente es de paredes fijas y su volumen no puede cambiar.
Gay-Lussac descubrió que en cualquier momento de este proceso, el cociente entre la presión y la temperatura siempre tenía el mismo valor:
(servicios.encb,15)
EwjD0u2ur4vQAhUqqlQKHZn6C8sQ_AUIBigB#imgrc=9aJUpJ2eDdkwQM%3A
http://www.educaplus.org/gases/ley_boyle.html,AÑO12,TOMADO EL 31/10/16
http://servicios.encb.ipn.mx/polilibros/fisicoquimica/gases/Ley%20charles.htm,AÑO 15,TOMADO EL 31/10/16
CIELO AGUILAR
|